Die FDA hat gerade mehrere 15-minütige Bluttests zum Abschirmen auf Coronavirus in Ordnung gebracht, aber es gibt Vorbehalte
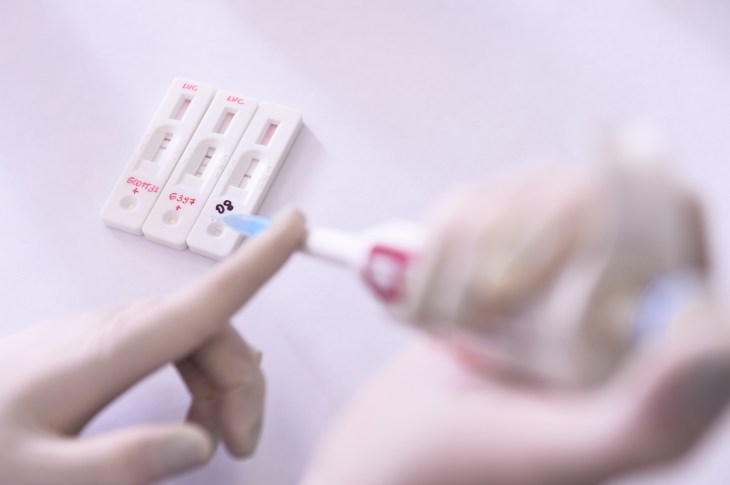
Am Donnerstag hat die FDA ihre Notfallpolitik rund um diagnostische Tests für SARS-CoV-2, das neuartige Coronavirus, das COVID-19 verursacht, geändert. Nach einer Änderung am 16. März öffnete die Agentur die Tür für eine Reihe von bestimmten privaten Einrichtungen und Labors, um Tests zu entwickeln und zu verteilen, die Ergebnisse vor Ort in nur 15 Minuten liefern können — aber es gibt einige ziemlich große Vorbehalte zu beachten, wie Sie hören über mehr davon, die auf den Markt kommen.
Die Tests, die “serologische” sind, d. h. sie identifizieren das Vorhandensein von Antikörpern im Blut einer Person, unterscheiden sich erheblich von den molekularen Tests, die derzeit im Rahmen der Notfallgenehmigung (EUA) von FDA-zugelassenen Labors und Drive-Through-Tests verwendet werden. Testsites. Die serologischen Tests zeigen, dass eine Person Antikörper gegen SARS-CoV-2 entwickelt hat, was bedeutet, dass sie sehr wahrscheinlich mit ihm in Kontakt gekommen sind (und sie entweder haben oder sich bereits davon erholt haben). Die molekularen Tests detektieren tatsächlich das Vorhandensein von viraler DNA im Blutstrom, was ein viel definitiverer Indikator dafür ist, dass sie derzeit eine aktive Infektion haben (zumindest zum Zeitpunkt der Einnahme des Tupfers).
Serologische Tests wurden in Ländern, in denen sich die Reaktion auf die COVID-19-Pandemie als wirksam erwiesen hat, auch in China, Taiwan und Singapur, noch immer häufig eingesetzt. Sie wurden auch in verschiedenen Gemeinden in den USA verwendet, basierend auf früheren Richtlinien rund um private Labordiagnosen. Aber am 26. März benannte die FDA 29 Stellen, die der Behörde die Benachrichtigung nach Bedarf zur Verfügung stellten und nun in der Lage sind, ihre Tests zu verteilen.
Es ist wichtig zu beachten, dass diese Tests nicht von der FDA überprüft oder validiert wurden, im Gegensatz zu den molekularen Tests, die in der Notfall-Einsatz-Kategorie der Organisation enthalten sind. Stattdessen beabsichtigt die FDA “nicht, einwände an der Entwicklung und Verbreitung dieser Tests durch kommerzielle Hersteller einzuwenden”, sofern sie eine Reihe von Kriterien erfüllen, einschließlich der Qualifizierung der Ergebnisse ihrer gemeldeten Testergebnisse mit den folgenden Informationen:
- Dieser Test wurde nicht von der FDA überprüft.
- Negative Ergebnisse schließen sarS-CoV-2-Infektionen nicht aus, insbesondere bei Patienten, die mit dem Virus in Kontakt waren. Folgetests mit einer molekularen Diagnostik sollten in Betracht gezogen werden, um eine Infektion bei diesen Personen auszuschließen.
- Die Ergebnisse von Antikörpertests sollten nicht als alleinige Grundlage verwendet werden, um eine SARS-CoV-2-Infektion zu diagnostizieren oder auszuschließen oder um den Infektionsstatus zu informieren.
- Positive Ergebnisse können auf eine frühere oder gegenwärtige Infektion mit nicht-SARS-CoV-2 Coronavirus-Stämmen wie Coronavirus HKU1, NL63, OC43 oder 229E zurückzuführen sein.
Die FDA stellt in ihrer Notfall-Verwendung FAQ ausdrücklich fest, dass diese Entitäten ihre eigene Validierung dieser Tests gemeldet haben, und dass sie keine Notfall-Nutzungsgenehmigung verfolgen werden. Das heißt, es gibt jetzt nichts, was die Entitäten auf dieser Liste davon abhält, ihre Tests zu verteilen, was bedeutet, dass sie in der Lage sein werden, in der Lage zu sein, Amerikaner zu testen und ein größeres Bild der möglichen Ausbreitung des neuartigen Coronavirus zu malen – mit dem oben erwähnten Vorbehalt, dass die FDA diese Tests nicht allein als positive Bestätigung eines bestimmten SARS-CoV-2-Falls betrachtet, oder umgekehrt, ein sicherer Indikator dafür, dass jemand das Virus nicht hat.
In Ermangelung besserer Optionen wie der erweiterten Verfügbarkeit der im Rahmen der ERE zugelassenen Tests werden diese serologischen Tests (von denen viele ergebnisse vor Ort nur mit einem Nadelstich Blut liefern können) nützlich sein, um ein genaueres Bild der Gesamtverbreitung und Reichweite des Coronavirus, insbesondere für kleinere Kliniken, GP-Kliniken und lokale Labore, die keinen bevorzugten Zugang zu den Geräten und Vorräten haben, die für die molekularen Testbemühungen benötigt werden.
Ein Test auf dieser Liste, das Healgen Scientific COVID-19 IgG/IgM (Whole Blood/Serum/Plasma) Rapid Test Device, benötigt beispielsweise keine Instrumentierung und kann in nur 15 Minuten Ergebnisse liefern. Distributor Ideal Rehab Care arbeitet mit seiner rechtsvertretenden Fox Rothschild zusammen, um die Tests aus Singapur “so schnell wie möglich” zu importieren.
Die FDA aktualisiert ihre Website mit Healgen als eine der Entitäten, die es von der Absicht, seine serologischen Test zu verwenden, ist, was die Fähigkeit für das Unternehmen, den Vertrieb zu beginnen freigeschaltet: Es ist immer noch illegal für jedermann nicht auf dieser Liste, dies zu tun , und die FDA verbietet auch weiterhin ausdrücklich die Verwendung von serologischen Tests zu Hause in ihren offiziellen Richtlinien.
Keywords: afds, afdsafds










